A csoport általános kutatási területe a fehérjék szerkezete, szerkezeti dinamikája, konformációs flexibilitása és működése közötti összefüggések feltárása. Különös figyelmet fordítunk a fehérje-fehérje kölcsönhatások és az allosztérikus jelátvitel szerepére a különböző biológiai folyamatokban. Modell fehérjéink elsősorban olyan komplement proteázok és allosztérikus enzimek, amelyek önszerveződő módon képesek bonyolultabb struktúrákba rendeződni. A csoportban összehangolt módon mind kísérleti, mind pedig számítógépes elméleti munka is folyik.
Főbb kutatási témák
A komplementrendszer aktiválódása és szabályozása
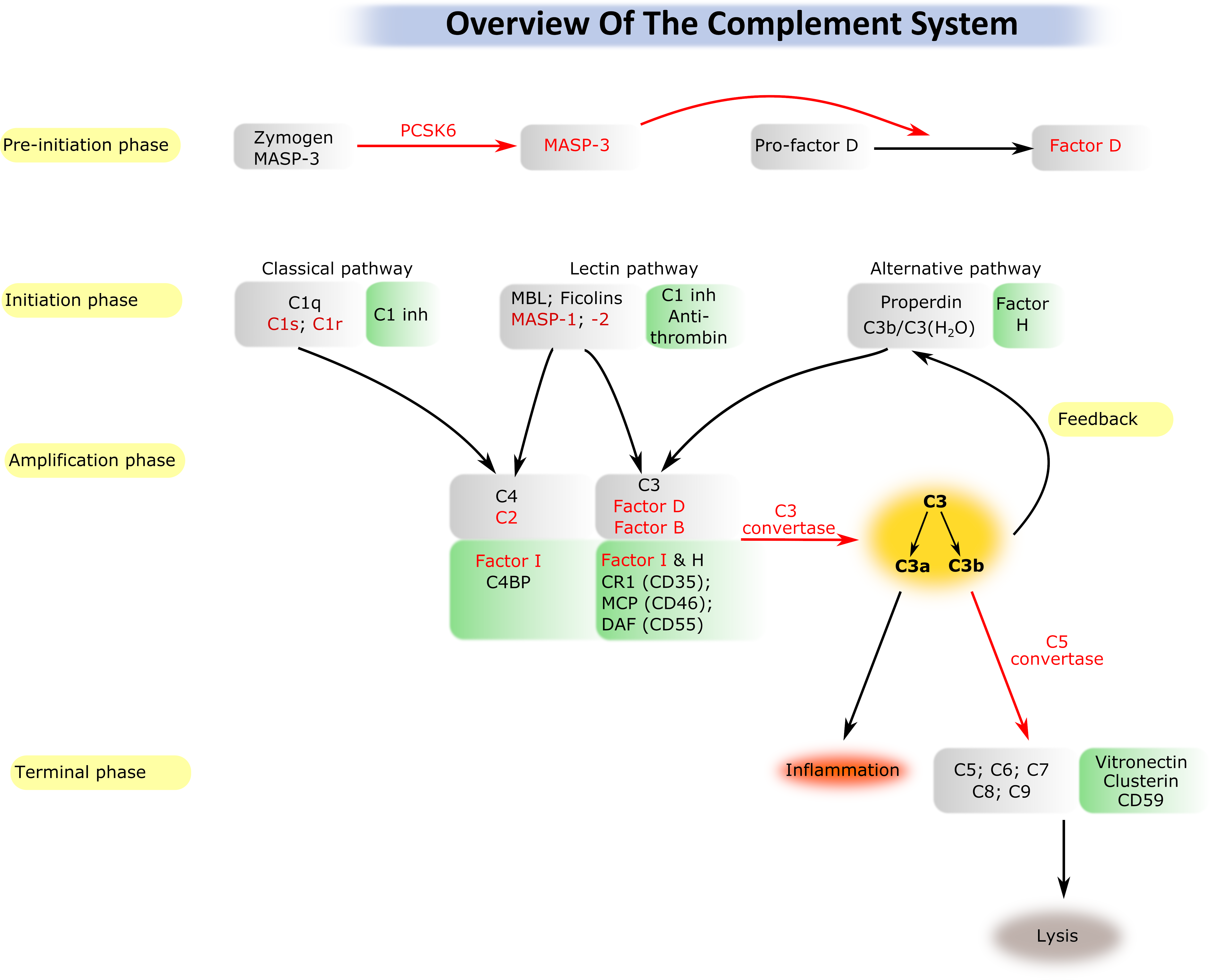
A komplementrendszer a természetes (veleszületett) immunitás egyik ősi ága. A kb. 40 fehérjemolekulából álló rendszer képes a veszélyes struktúrákat (pl. patogén mikroorganizmusok) felismerni, megjelölni és megsemmisíteni. A rendszer gerincét olyan szerin proteáz enzimek alkotják, amelyek egymást kaszkádszerűen aktiválják. A komplementrendszer normális működése szükséges az immunegyensúly fenntartásához; rendellenes, kontroll nélküli aktiválódása azonban a saját szövetek károsodásához vezethet. Manapság egyre több betegségről derül ki, hogy hátterében kisebb vagy nagyobb mértékben a komplementrendszer rendellenes aktiválódása áll. Csoportunkban elsősorban a komplementrendszer beindításában résztvevő szerin proteáz enzimekkel foglalkozunk. Rekombináns formában előállítjuk a különböző proteázokat és szerkezeti biokémiai, biofizikai és enzimológiai módszerekkel jellemezzük tulajdonságaikat. Különös hangsúlyt fektetünk a komplement szerin proteázokat gátló természetes és mesterséges inhibitorok tanulmányozására, fejlesztésére. A közelmúltban számos szerin proteáz térszerkezetét határoztuk meg, tisztáztuk az aktiválódás egyik útjának (lektin út) pontos mechanizmusát, valamint felfedeztünk egy új gyulladáskeltő mechanizmust.
A fehérjék funkcionális szabadenergia-hiperfelszíne

A fehérjék szabadenergia-felszínének illusztrációja. A tölcsér alakú felszín alsó, bonyolult domborzatú része a funkcionális szabadenergia-felület.
A funkcionális energiafelszín a fehérjék szabadenergia-hiperfelszínének az a részlete, amely a natív állapotnak felel meg. A fehérje funkcionális mozgásai (katalízis, ligandkötés, allosztérikus szabályozás) ezen a bonyolult topológiájú hiperfelületen mennek végbe. E hiperfelszín általános tulajdonságait (hierarchikus jelleg, a dinamika természete, stb.) tervezzük feltárni a fehérjék egy szerkezetileg reprezentatív részhalmazán, elsősorban az Intézetben egyéb szempontok szerint vizsgált fehérjéken. Az egyes fehérjék funkcionális dinamikáját különböző szemcsézettségű modellek szimulációja és különféle elemző eljárások révén határozzuk meg. Különös szerepe van a funkcionális hiperfelszínnek az allosztéria mechanizmusainak, jelátviteli útvonalainak megértésében. E célból a fehérjekomplexek szerkezetét in silico felépítjük és a kommunikációt hálózatos modellekkel írjuk le.
Baktériumok flagelláris szekréciós rendszerének vizsgálata
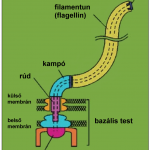
A bakteriális ostor (flagellum) a baktériumok fő mozgásszerve. Három fő részből épül fel: a bazális testből, a kampóból és a hosszú filamentumból. A filamentumot alapvetően a flagellin nevű fehérje építi fel, akár több tízezer monomer alegység önszerveződésének eredményeként. A flagellin monomerek az ostor közepén található, kb. 20 Å átmérőjű csatornán át jutnak ki a filamentumból, ahol beépülnek annak a végére. A flagellin több más komponenssel egyetemben a flagelláris szekréciós rendszer (más néven export rendszer) segítségével jut be a központi csatornába. Ennek a pontos mechanizmusa azonban máig sem ismert. Csoportunkban a flagelláris export rendszer (feltételezett) komponenseinek pontos szerepét kívánjuk tisztázni, továbbá vizsgáljuk a flagelláris export rendszer biotechnológiai alkalmazhatóságát rekombináns fehérjék szekretált formában történő előállítására.
A rákos és gyulladásos folyamatokban szerepet játszó jelátviteli fehérjék kölcsönhatásainak kimutatása és jellemzése
A sejtek alapvető élettani folyamatai lényegében makromolekuláris hálózatok szabályozott működésén nyugszanak. A jelátviteli útvonalak különböző típusú (erős és gyenge, közvetlen és közvetett) fehérje-fehérje kölcsönhatásokból állnak, melyek megfelelően szabályozzák a rendszerint allosztérikus természetű enzimek működését. A fehérjekonformáció flexibilitásán alapuló allosztérikus szabályozás jelentősége az enzimek működésében jól ismert és csoportunk korábbi, egyedi enzimek vizsgálatával elért kísérleti eredményei további betekintést nyújtottak ilyen mechanizmusokba. E tudás birtokában a jelen projekt keretében olyan jelátviteli folyamatokban szerepet játszó enzim-enzim kölcsönhatásokat kívánunk azonosítani és molekuláris szinten jellemezni, amely folyamatok patofiziológiás jelentősége feltételezhető. Pl. a krónikus gyulladásos és rákos folyamatok között sejthető összefüggés vizsgálatainkat olyan fehérje-fehérje kölcsönhatások tanulmányozása felé tereli, melyekben bizonyos kinázok (Aurora, Rock1, Rock2 ill. foszfoglicerát kináz) és foszfodiészterázok (PDE4, PDE5) szerepe vár tisztázásra. A kölcsönhatások feltérképezését és jellemzését egyrészt in vivo emlős sejteken végzett, másrészt in vitro enzimológiai és fehérjekémiai vizsgálatokkal végezzük.
Aktuális együttműködések
Komplement kutatás
ELTE Biokémiai Tanszék, Kémiai Intézet
SOTE III. sz. Belgyógyászati Klinika, Kutatólaboratórium
University of Aarhus, Dánia
University Hospital, Bern, Svájc
University of British Columbia, Vancouver, Kanada
Bioinformatika
SOTE Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet
University of Michigan, USA
Flagelláris szekréció
Pannon Egyetem, Veszprém
Főbb műszerek, berendezések
FPLC berendezés fehérjetisztításhoz
QCM, DSC, FT IR
Oktatási tevékenység
Alapképzés: Pázmány Péter Katolikus Egyetem, Műszaki Informatikai Kar: biokémia, biofizika, molekuláris biológia oktatása; ELTE TTK: biofizika, fizikai-biokémia kurzusok
B.Sc. és M.Sc. szakdolgozók témavezetése: ELTE (biológus, vegyész), BME (biomérnök)
Ph.D. hallgatók témavezetése: ELTE Biológiai Doktori Iskola, BME Oláh György Doktori Iskola
Vezető
Gál Péter