Kutatási terület
A konformációs betegségek, mint a Parkinson-kór (PD) és a Multiszisztémás Atrófia (MSA), a neurodegeneratív betegségek jelentős részét ölelik fel. Ezeknek a betegségeknek a fémjelző fehérjéi az α-synuclein (SYN) és a Sejtarchitektúra csoport által a közelmúltban felfedezett Tubulin Polymerization Promoting Protein (TPPP/p25). A két fehérje normál agyban a neuronokban (SYN) illetve az oligodendrocitákban (OLGs) (TPPP/p25) fejeződik ki; azonban patológiás körülmények között a szinuklenopátiákra jellemző módon együtt dúsulnak fel és ko-lokalizálnak mind neuronális (PD), mind gliális (MSA) agyi zárványokban (Oláh et al., 2020). Ezek a rendkívül magas konformációs flexibilitással bíró un. neomorf moonlighting fehérjék, fiziológiai és neurotikus funkciókat is mutatnak; azonban patológiás körülmények között asszociálnak, aggregátumaik alakulnak ki, melyek neurológiai megbetegedésekhez vezetnek. A betegségre jellemző a TPPP/p25-SYN, de nem a fiziológiás TPPP/p25-tubulin asszociátumok kialakulása. Mindazonáltal, specifikus befolyásolásuk megoldást igényel, javaslatunk szerint a TPPP/p25-SYN kötőfelszíne szolgálhat specifikus kiindulópontként a Parkinson-ellenes gyógyszerek fejlesztésére (Oláh et al., 2021).
Ennek fényében új innovatív stratégiát dolgoztunk ki, amely a patológiás TPPP/p25-SYN komplex kötőfelszínének azonosításán alapul, lehetővé téve specifikus gyógyszercélpont validálását, gyógyszerjelölt molekulák, pl. peptidomimetikus foldamerek kifejlesztését (Szunyogh et al., 2015; Szénási et al., 2017). Legújabb kutatási eredményeink bizonyították, hogy az un. interface-targeting molekulák bevetése révén lehetővé válik a toxikus SYN-TPPP/p25 komplexek/asszociátumok proteolítikus degradációja is az autofágia és az ubikvitin-proteaszóma lebontó rendszerek működése révén (Lehotzky et al., 2021). Következésképpen, mindkét fehérje alkalmassá válik fiziológiás funkcióik betöltésére.
Fiziológiás körülmények között a TPPP/p25 a mikrotubulus hálózat dinamizmusának szabályozásában vesz részt; kulcstényező a differenciált OLGs kialakulásában, melyek az axonokat körül ölelő myelin hüvely fő alkotó elemei. Miután a TPPP/p25-indukált SYN oligomerizáció/aggregáció vezet a szinukleinopátiák kialakulásához, így kölcsönhatásuk specifikus megszüntetése kritikus a TPPP/p25-tubulin/mikrotubulus kapcsolatok megtartásának szempontjából. Vizsgálataink emellett rávilágítanak arra, hogy a multifunkcionális fehérjék drug targeting-je nehéz és komplex vállalkozás; vizsgálataink szerint gyógyszercélpont meghatározásához a patológiás körülmények között jellemző fehérje komplex kötőfelszínének azonosítása adhat megfelelő választ.
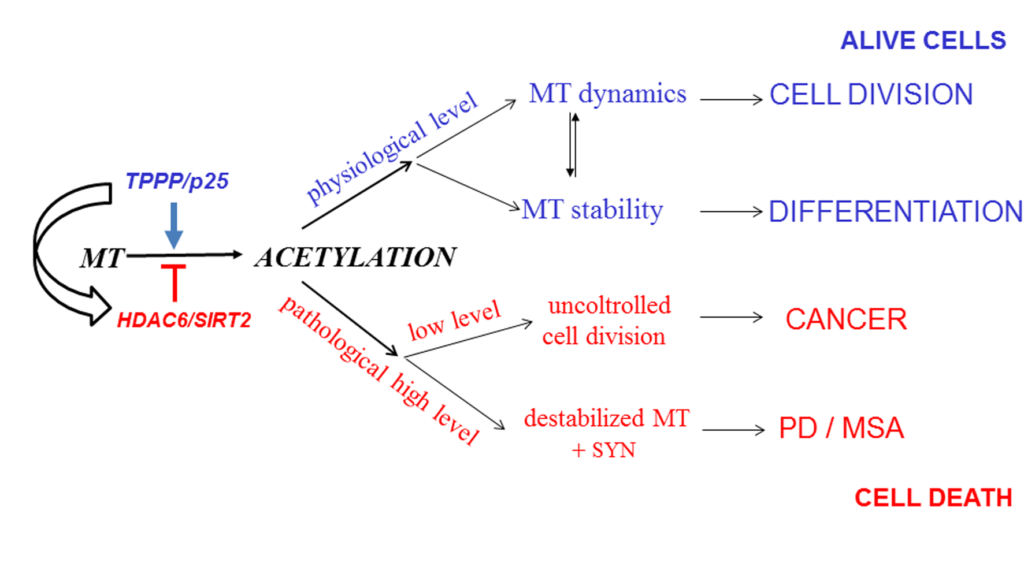
Összefoglalva elmondhatjuk, hogy a különböző szub-atomi és sejtszintű asszociációk vizsgálata feltárta a TPPP/p25 konformációs sokoldalúságát, kaméleon jellemzőit, amely kiemelkedő interakciós potenciált garantál. Fiziológiás szempontból a moonlighting TPPP/p25 modulálja a mikrotubulusok hálózatának sokrétű funkcióját kötegelésük és acetilációjuk fokozásával, melyet a specifikus tubulin dezacetilázok gátlásával érnek el (Szabó et al., 2017; Schiedel et al., 2018 and 2020). Megállapítottuk, hogy a TPPP/p25-modulált mikrotubulus hiperacetiláció ellensúlyozni képes a kontrollálatlan sejtosztódást, mely a tumorgenezis jellemzője. A legújabb felismerés szerint a citoszkeleton filament rendszerei a SARS-CoV-2 vírus terjedésében, a COVID-19 betegségben is szerepet játszanak (Norris and Ovádi, 2021). Ezen eredmények rávilágítanak a TPPP/p25 anti-mitotikus hatására is, ami összhangban van azzal a klinikai megállapítással, hogy a PD-ben szenvedő betegek esetében csökken bizonyos rákos megbetegedések kockázata.
Hivatkozások
Lehotzky A, Oláh J, Fekete JT, Szénási T, Szabó E, Győrffy B, Várady G, Ovádi J. Co-Transmission of Alpha-Synuclein and TPPP/p25 Inhibits Their Proteolytic Degradation in Human Cell Models. Front Mol Biosci. 2021 May 18;8:666026. doi: 10.3389/fmolb.2021.666026. eCollection 2021. PMID: 34084775
Norris V, Ovádi J. Role of Multifunctional Cytoskeletal Filaments in Coronaviridae Infections: Therapeutic Opportunities for COVID-19 in a Nutshell. Cells. 2021 Jul 19;10(7):1818. doi: 10.3390/cells10071818. PMID: 34359986
Oláh J, Lehotzky A, Szunyogh S, Szénási T, Orosz F, Ovádi J. Microtubule-Associated Proteins with Regulatory Functions by Day and Pathological Potency at Night. Cells. 2020 Feb 4;9(2):357. doi: 10.3390/cells9020357. PMID: 32033023
Oláh J, Lehotzky A, Szénási T, Ovádi J. A potential innovative therapy for Parkinson’s disease: Selective destruction of the pathological assemblies of alpha-synuclein. In: Lin, Zhang (szerk.) Dementia in Parkinson’s Disease. London, Egyesült Királyság / Anglia : IntechOpen (2021)
Schiedel M, Lehotzky A, Szunyogh S, Oláh J, Hammelmann S, Wössner N, Robaa D, Einsle O, Sippl W, Ovádi J, Jung M. HaloTag-Targeted Sirtuin-Rearranging Ligand (SirReal) for the Development of Proteolysis-Targeting Chimeras (PROTACs) against the Lysine Deacetylase Sirtuin 2 (Sirt2)*. Chembiochem. 2020 Dec 1;21(23):3371-3376. doi: 10.1002/cbic.202000351. Epub 2020 Aug 27. PMID: 32672888
Schiedel M, Herp D, Hammelmann S, Swyter S, Lehotzky A, Robaa D, Oláh J, Ovádi J, Sippl W, Jung M. Chemically Induced Degradation of Sirtuin 2 (Sirt2) by a Proteolysis Targeting Chimera (PROTAC) Based on Sirtuin Rearranging Ligands (SirReals). J Med Chem. 2018 Jan 25;61(2):482-491. doi: 10.1021/acs.jmedchem.6b01872. Epub 2017 Apr 17. PMID: 28379698
Szabó A, Oláh J, Szunyogh S, Lehotzky A, Szénási T, Csaplár M, Schiedel M, Lőw P, Jung M, Ovádi J. Modulation Of Microtubule Acetylation By The Interplay Of TPPP/p25, SIRT2 And New Anticancer Agents With Anti-SIRT2 Potency. Sci Rep. 2017 Dec 6;7(1):17070. doi: 10.1038/s41598-017-17381-3. PMID: 29213065
Szénási T, Oláh J, Szabó A, Szunyogh S, Láng A, Perczel A, Lehotzky A, Uversky VN, Ovádi J. Challenging drug target for Parkinson’s disease: Pathological complex of the chameleon TPPP/p25 and alpha-synuclein proteins. Biochim Biophys Acta Mol Basis Dis. 2017 Jan;1863(1):310-323. doi: 10.1016/j.bbadis.2016.09.017. Epub 2016 Sep 24. PMID: 27671864
Szunyogh S, Oláh J, Szénási T, Szabó A, Ovádi J. Targeting the interface of the pathological complex of α-synuclein and TPPP/p25. Biochim Biophys Acta. 2015 Dec;1852(12):2653-61. doi: 10.1016/j.bbadis.2015.09.012. Epub 2015 Sep 25. PMID: 26407520
Ovádi Judit https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=10000292
Orosz Ferenc https://m2.mtmt.hu/gui2/?type=authors&mode=browse&sel=authors10000310
Pályázatok
A rendezetlen TPPP/p25 fiziológiás és patológiás kölcsönhatásai: kötő motívumok feltérképezése. OTKA K-101039 (2012-2016) Témavezető: Ovádi Judit
A Tubulin Polimerizációt Promótáló Protein (TPPP/p25) szerepe az idegrendszer sejtvédő folyamataiban, az autofágiában, a proteaszóma és aggreszóma rendszerekben. OTKA K-112144 (2015-2017) Témavezető: Ovádi Judit
ÚT A PARKINSON-KÓR SZEMÉLYRE SZABOTT KEZELÉSÉHEZ. RICHTER Nyrt-KK/342/2018 RICHTER GEDEON Nyrt. Témavezető: Ovádi Judit
Zinc-Net: the Network for the Biology of Zinc. EU COST Action TD1304 (2013-2017)
Epigenetic Chemical Biology (EPICHEM). EU COST Action -TD0905 (2014-2018)
Oktatási tevékenység
Hazai egyetemi és poszt-graduális képzés: 2 MSc fokozat, 10 PhD és 12 diploma munka/TDK dolgozat
Külföldi egyetemi és poszt-graduális képzés: 2011 Cordoba (Argentina)
(EU-Latin-Amerika projekt keretében) 2012 Araraquara (Brazilia)
Egyetemi külső bizottsági tagság: ELTE Biológia Doktori Iskola Bizottság, ELTE TTK Habilitációs Bizottság
MTA Tudomány- és Technikatörténeti Osztályközi Tudományos Bizottság
Együttműködő partnerek
Nemzetközi együttműködés
Prof. Marival Bermejo, Institute of Pharmacology, Miguel Hernández University, Spain
Prof. Manfed Jung, Albert-Ludwigs-Universität Freiburg, Germany
Prof. Gabor G. Kovacs, University of Toronto, Toronto, Canada
Dr. Katalin Medzihradszky, UCSF, School of Pharmacy, Department of Pharmaceutical Chemistry, San Francisco, CA, USA
Prof. Victor Norris, Faculty of Science, University of Rouen, France
Dr. László Tirián, Institute of Molecular Biotechnology of the Austrian Academy of Sciences (IMBA), Vienna BioCenter (VBC), Vienna, Austria
Hazai együttműködés
Prof. Berki Timea, Immunológiai Intézet, Pécsi Tudományegyetem, Pécs
Prof. Erdei Anna, Immunológiai Tanszék, ELTE, Budapest
Prof. Fidy Judit, Biofizika Tanszék, Semmelweis Egyetem, Budapest
Prof. Kovács János, Anatómiai, Sejt- és Fejlődésbiológiai Tanszék, ELTE, Budapest
Prof. Magyar Anna, Peptidkémiai kutatócsoport, ELTE, Budapest
Prof. Penke Botond, Orvosi Kémiai Intézet, Szegedi Tudományegyetem, Szeged
Prof. Perczel András, Szerves Kémiai Tanszék, Kémiai Intézet, ELTE, Budapest
Prof. Vécsei László, Neurológiai Intézet, Szegedi Tudományegyetem, Szeged
TTK-n belüli együttműködés
Prof. Győrffy Balázs, Onkológiai Biomarker Kutatócsoport, Enzimológiai Intézet
Dr. Várady György, Molekuláris Sejtbiológiai Kutatócsoport, Enzimológiai Intézet
Dr. Tőke Orsolya, NMR Kutató Laboratórium Műszercentrum
Korábbi, a csoportban PhD fokozatot szerzett munkatársak
Dr. Horváth István 2010, to Chalmers University of Technology, Gothenburg, Sweden
Dr. Tőkési Natália 2012, to TTK Enzimológiai Intézet Membrán Fehérje Kutatócsoport
Dr. Zotter Ágnes 2013, to Department of Biomolecular Sciences, Weizmann Institute of Science, then TargetEx Biosciences
Dr. Szunyogh Sándor 2017, to Department of Physiology, Anatomy and Genetics, Division of Medical Sciences at the University of Oxford, Oxford Parkinson’s Disease Centre
Dr. Szabó Adél 2020, to Versys Clinics, Human Reproduction Institution
Vezető
Hunyady László


