Metabolikus Gyógyszer-kölcsönhatások Kutatócsoport
Kutatási terület:
A gyógyszeres terápia során jelentkező nem-kívánt mellékhatások részben a gyógyszer-lebontás eltéréseiből vagy megváltozásából fakadnak. A kutatócsoport munkatársai több mint 20 éve foglalkoznak a gyógyszerek lebontásában és kiürítésében mutatkozó egyéni különbségekkel. Érdeklődésük középpontjában a gyógyszerek és egyéb testidegen anyagok metabolizmusában meghatározó szerepet játszó citokróm P450 (CYP) enzimek működése és szabályzása áll.
Biokémiai, molekuláris biológiai és tömegspektrometriai módszerekkel vizsgálják I) a forgalomban lévő gyógyszerek, és a fejlesztés alatt álló gyógyszerjelöltek metabolizmusát és farmakokinetikai interakciós sajátságait, II) a CYP enzimek expresszióját, működését befolyásoló tényezőket (hormonális hatások, betegségek, gyógyszeres terápia), III) valamint az egyéni gyógyszer-metabolizáló képesség meghatározásával a személyre szabott gyógyszeres terápia kialakításához nyújtanak diagnosztikai hátteret.
Kutatási témák:
1. CYP enzimek aktivitását befolyásoló genetikai és nem-genetikai tényezők
A gyógyszer-hatóanyagok metabolizmusában résztvevő CYP enzimek farmakogenetikai vizsgálata hozzájárul a személyre szabott gyógyszeres terápia kialakításához. A gyógyszer-metabolizáló enzimek fenotípusos megjelenését elsősorban az enzimek genetikai polimorfizmusai (funkció-vesztő vagy funkció-fokozó mutációk, génkópiaszám-változások) befolyásolják, amely csökkent vagy fokozott enzimaktivitást, illetve akár a teljes enzimfunkció kiesést is eredményezhet. Azonban a genotípus alapján várható aktivitáshoz képest időszakosan csökkent/növekedett metabolizáló képesség figyelhető meg nem-genetikai tényezők (például kor, nem, gyógyszer-kölcsönhatásból fakadó enzimgátlás és indukció, illetve megbetegedések) hatására. Ezt a jelenséget fenokonverziónak nevezzük, mely jelentősen torzíthatja a hatóanyagok biotranszformációjában kiemelkedő szerepű enzimek genotípus alapú aktivitás becslését.

Genetikai és nem-genetikai faktorok szerepe az egyéni gyógyszer-metabolizáló kapacitás kialakításában.
Klinikailag releváns polimorf CYP allélvariánsok és nem-genetikai faktorok hatását értékelték humán májszövet-minták felhasználásával. A polimorf CYP allélvariánsok hatásának becsléséhez elengedhetetlen a génspecifikus és pontos genotipizálási és haplotípus meghatározási módszerek alkalmazása, mely a CYP1A2, CYP2B6 és CYP2D6 enzimek esetében komoly PCR alapú módszer fejlesztéseket igényelt. A genetikai tényezők mellett számos nem-genetikai tényező, mint a nem, gyógyszeres kezelések, krónikus alkohol fogyasztás szerepe is jelentősnek bizonyult az egyes CYP fenotípusok kialakításában, például a CYP2B6, CYP2C9, CYP2C19, CYP2D6 fenokonverziójában.
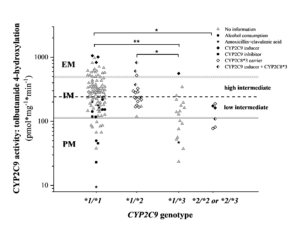
A máj CYP2C9 aktivitása (tolbutamid 4’-hidroxiláció) különböző CYP2C9 genotípusú egyénekben. A CYP2C9 genotípus alapján várható aktivitást nem-genetikai tényezők (CYP2C9 induktor és inhibitor terápia, amoxicillin+klavulánsav kezelés, krónikus alkoholfogyasztás) módosították, míg a CYP2C8 genotípus nem befolyásolta. A CYP2C9 medián aktivitása (szaggatott vonal) a közepesen magas („High intermediate”) és közepesen alacsony („Low intermediate”) metabolizálók közötti határértéket jelenti. PM: gyenge metabolizáló; IM: átlagos metabolizáló; EM: extenzív metabolizáló. * P<0.05; ** P<0.001 https://pubmed.ncbi.nlm.nih.gov/34429480/
A szteroid homeosztázis és a gyógyszer metabolizmus összefüggéseinek modellezése
A hormonális állapot természetes változásai, valamint a terápiában alkalmazott szteroid típusú vegyületek jelentős változásokat okozhatnak a CYP gén-expresszióban, illetve a CYP enzimfehérje szintekben. Vizsgálják a dehidroepiandroszteron, a dexametazon, és a koleszterin, mint szterán vázas vegyületek és a gyógyszer-metabolizáló CYP enzimek kapcsolatát is.

A dehidroepiandroszteron aktiválja a májban a CAR (konstitutív androsztán receptor) nukleáris receptort, amely sejtmagba lépve indukálja a CYP2B6, CYP2C9, CYP2C19 és CYP3A4 enzimek transzkripcióját.
2. A gyógyszer-metabolizáló képességhez igazított személyre szabott terápia kialakítása

A CYPtestTM diagnosztikai rendszer a gyógyszer-metabolizmusban résztvevő CYP enzimek aktuális szintjének meghatározásán (CYP expresszió), és a DNS analízissel megállapítható génhiba kimutatásán (CYP-genotipizálás) alapul. A módszert olyan betegcsoportoknál alkalmazzák, ahol több hatóanyag kerül együttes adagolásra, vagy ahol az egyéni gyógyszeres kezelés jelentősen javíthatja a gyógyszerek hatékonyságát és nagyban csökkentheti a toxicitás kockázatát. A módszer meghatározza a betegek (szervátültetett, pszichiátriai és neurológiai betegek, máj- és veseelégtelenségben, kardiovaszkuláris megbetegedésekben szenvedők) csökkent vagy fokozott gyógyszer-lebontó képességét, amely a gyógyszerhatás elmaradásához vagy súlyos mellékhatások kialakulásához vezethet. A CYP-státusz alapján előre jelzett ’gyenge vagy extenzív metabolizáló’ fenotípushoz igazított gyógyszerválasztással és dózis-optimalizálással a betegek hatékonyabb, kevesebb mellékhatással járó és költségtakarékos egyéni terápiája alakítható ki.
Személyre szabott gyógyszeres terápia lehetőségei
A kutatók szisztematikusan feltérképezték a gyógyszer metabolizmusban résztvevő CYP enzimek szerepét a pszichiátriai és neurológiai betegek kezelésében leggyakrabban alkalmazott antipszichotikumok, hangulat-stabilizálók és antiepileptikumok metabolizmusában, valamint a szervátültetett betegeknél alkalmazott immunszuppresszánsok eliminációjában. Vizsgálják, hogy a CYP enzimek interindividuális aktivitásbeli különségei (genetikai és nem-genetikai hátterű) milyen mértékben járulnak hozzá a gyógyszer hatékonyság és toxicitás egyéni eltéréseihez.
2.1. A CYP3A-státuszt meghatározó CYP3A5 genotípus és CYP3A4 expresszió befolyásolja a szervátültettek immunszuppresszív terápiáját. Máj-transzplantáltaknál a donor máj CYP3A-státusza felelős a ciklosporin, illetve a takrolimusz vérszint kialakításáért a recipiensekben. Az alacsony, vagy magas CYP3A4 expressziót mutató, illetve a CYP3A5*1 allélt hordozó májgrafttal transzplantált betegeknél a kiindulási kalcineurin inhibitor dózis jelentős módosítására van szükség. A donor CYP3A-státuszának meghatározása segítséget nyújt a recipiens műtét utáni kalcineurin inhibitor immunszuppreszáns terápiájának ésszerű módosításához.
A donor máj CYP3A-státusza alapján megkezdett takrolimusz terápia szignifikánsan csökkenti a takrolimusz terápiás koncentrációjának eléréséhez szükséges időt a klasszikus klinikai gyakorlat szerint dozírozott páciensekhez képest (4 nap vs 8 nap, P <0,0001). Az akut kilökődési epizódok (3,6 % vs 23,8%, P <0,0001) és a takrolimusz által kiváltott nefrotoxicitás (8 vs 27%, P = 0,0004) is ritkábban fordul elő a CYP3A-státuszhoz igazított takrolimusz kezelés során.
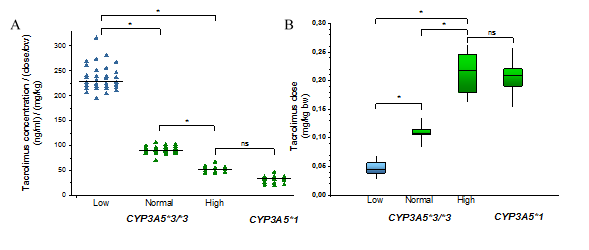
A) A donor máj CYP3A-statusának (CYP3A5 genotípus és CYP3A4 expresszió) hatása a takrolimus vérszintekre májtranszplantáción átesett betegeknél B) A recipiensek takrolimus dózisigénye különböző CYP3A-statusú májgraftok esetén (Low, Normal, High: alacsony, átlagos és magas szintű CYP3A4 expresszió; ns: nem szignifikáns)
A máj-transzplantáltaknál szerzett tapasztalatok hozzájárultak a szív-transzplantáción átesett betegek immunszuppressziós terápiájának beállításához. A posztoperatív terápia kezdeti időszakában nagy dózisú kortikoszteroid kezelés kihat a betegek gyógyszer-metabolizáló képességére a CYP3A enzimek transzkripciójának szabályozásán keresztül. A kutatócsoport szívtranszplantáción átesett betegek nyomon követésével a műtétet követő 15 hónapos időtartamban vizsgálta a recipiensek gyógyszer-metabolizáló képességének változását és azokat a tényezőket, amelyek módosíthatják az immunszuppresszív hatóanyagok (elsősorban a takrolimusz) farmakokinetikáját. https://www.nature.com/articles/s41598-021-00942-y

A dózissal normalizált takrolimusz vérkoncentráció a CYP3A5*3/*3 genotípussal rendelkező (CYP3A5 enzimhiányos) (A) és CYP3A5*1 alléllal rendelkező (B) szívtranszplantált recipienseknél a műtétet követő 15 hónapos időszakban. A szaggatott vonal a kortikoszteroid napi dózisát jelöli *P <0,0001
2.2. A CYP2C9 csökkent működésének klinikai következményeit vizsgálták epilepsziás gyermekek bevonásával is. A kutatók megállapították, hogy a valproát, az epilepszia kezelésében elsőként választott szer metabolizmusát gyermekekben elsősorban a CYP2C9 enzim katalizálja. A CYP2C9 génben előforduló funkció-vesztő mutációk azonban csak rész-információt szolgáltatnak a beteg valproát-lebontó képességéről, a vérszint kialakulásában jelentős szerepe van a CYP2C9 expressziójának.

A CYP2C9-status hatása a gyermekek valproát szérumkoncentrációira (CYP2C9*1/mut: heterozigóta CYP2C9 genotípus (CYP2C9*1/*2 vagy CYP2C9*1/*3); normal: átlagos CYP2C9 expresszálók; Low: alacsony CYP2C9 expresszálók)
A kutatók a betegek CYP2C9 státusza alapján javaslatot tettek az optimális vérszintet eredményező valproát adagolásra.

A különböző CYP2C9-statussal rendelkező epilepsziás gyermekek napi valproát dózis igénye
A CYP2C9 genotípus és a CYP2C9 expresszió együttes értékelésével meghatározott valproát dozírozás jelentősen csökkentette a terápiás vérszinttől eltérő (magasabb vagy alacsonyabb) valproát koncentrációk kialakulását, a kóros alkalikus foszfatáz emelkedést, valamint a súlyos mellékhatás, a hiperammonémia gyakoriságát.
2.3. A görcsgátló, nyugtató hatású klonazepam mellékhatásai a metabolizmusában résztvevő CYP3A és NAT2 (N-acetil-transzferáz 2) enzimeknél megfigyelhető jelentős egyéni különbségekre vezethetők vissza. Pszichiátriai betegek bevonásával végzett vizsgálatok során igazolták, hogy a klonazepam plazmakoncentrációja összefüggésben van a betegek CYP3A4 expressziójával, azonban a CYP3A5 és NAT2 genotípus nincs hatással a ’steady-state’ klonazepam koncentrációra.

A) Normalizált klonazepam vérszintek és a CYP3A4 expresszió közötti összefüggés ( a sárga pontok a CYP3A5*1/*3 genotípusú betegeket, — a mediánt jelöli) B) A CYP3A4 expresszió és a NAT2 acetiláló fenotípus hatása a 7-aminoklonazepam/klonazepam koncentráció arányára (Low: alacsony CYP3A4 expresszálók, Normal: átlagos CYP3A4 expresszálók, High: magas CYP3A4 expresszálók; Slow: lassú NAT2 acetilálók, Fast: gyors NAT2 acetilálók)
Ugyanakkor a normál CYP3A4 aktivitás lassú NAT2 acetiláló képességgel párosulva a 7-aminoklonazepam metabolit felhalmozódásához vezet, amely rontja a klonazepam hatékonyságát és a gyógyszer visszavonásakor súlyos megvonási tünetek kialakulásához vezet. A betegek CYP3A4 expressziójának és a NAT2 genotípusának ismerete segíti a mellékhatások szempontjából nagy kockázatú betegek beazonosítását és a személyre szabott klonazepam terápia kialakítását.
2.4. A terápia rezisztens szkizofrénia kezelésének leghatékonyabb ágense a klozapin. Ugyanakkor a terápia sikeressége nagyban függ a klozapin vérszintek alakulását befolyásoló tényezőktől. Alacsony CYP1A2 expresszió esetén, a klozapin vérszintek alakulásában a CYP3A4-státusz ismerete a meghatározó. Működőképes CYP3A5*1 allél jelenléte pedig alacsony CYP3A4 expresszió esetén van hatással klozapin koncentrációkra. A klozapin N-oxid/klozapin és a norklozapin/klozapin koncentráció arányok szintén a CYP3A4 expresszióval mutattak összefüggést, tovább erősítve a CYP3A4 enzim szerepét a klozapin lebontásában.
3. In vitro modellek fejlesztése
Gyógyszerhatóanyagok in vitro vizsgálatára különböző in vitro modelleket születtek, amelyek jól használhatóak farmakológiai, farmakokinetikai és toxicitási vizsgálatokban.
3.1. Humán indukált pluripotens őssejt alapú agyi organoidok használata farmakológiai és toxicitási vizsgálatokban
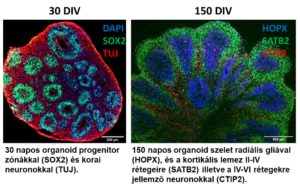
Az elöregedő társadalmaknak új kihívásokkal kell szembenézniük, amelyek közül az egyik legsúlyosabb a neurodegeneratív és a tumoros betegségek egyre gyakoribb megjelenése. Annak érdekében, hogy ezekkel a betegségekkel sikeresen lehessen felvenni a harcot a modellrendszerek fejlesztésekor a kutatók az emberi szervezet minél pontosabb leképezésére törekednek. Az agy esetében erre képesek a cerebrális organoidok, amelyek nem csak a kortikális lemezt alkotó sejttípusokat, de azok strukturális elrendeződését is megfelelően reprodukálják. Ezekből az organoidokból olyan szelettenyészeteket hoznak létre, amelyek levegő-folyadék határon növesztve akár egy évig is fenntarthatóak. Így ki tudnak fejlődni érett neuronális és glia sejttípusok, amelyek lehetővé teszik neurodegenratív betegségek, mint az amiotrófiás laterálszklerózis vagy a frontotemporális demencia (ALS/FTD) korai sejt típus specifikus patológiás elváltozásainak vizsgálatát és olyan gyógyszermolekulák kutatását, amelyek képesek megelőzni vagy lassítani a betegséget (Szebényi et al., 2021). http://www.ttk.hu/aktualis-hirek/laboratoriumban-novesztett-vilagszinvonalu-mini-agy-betegsegmodell-valik-elerhetove-a-termeszettudomanyi-kutatokozpontban
3.2. Terápia-rezisztenciához vezető farmakokinetikai változások daganatokban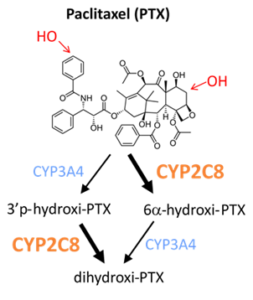
Az Országos Korányi Pulmonológia Intézettel és a Gyógyszer Rezisztencia Kutatócsoporttal folytatott együttműködésben a kutatók arra keresik a választ, hogy a daganat-terápiában tapasztalt és nagy problémát jelentő terápia-rezisztencia milyen farmakokinetikai változás(ok)nak köszönhető(ek).Céljuk olyan sejt-modell létrehozása, amelyben vizsgálni tudják a paclitaxel metabolizmusában résztvevő enzimek kópiaszám-változását és a paclitaxel citotoxicitását a mesterségesen rezisztenssé tett (különböző metabolizáló képességű, eltérő CYP kópiaszámú) sejtekben.
3.3. Biomarkerek fejlesztése toxikológiai és biztonsági vizsgálatokhoz
A kutatócsoport által végzett munka egyik fő célkitűzése, hogy olyan extracelluláris mikroRNS alapú biomarkereket találjanak, amelyek szervspecifikusan, a hagyományos eljárásoknál hamarabb képesek egy adott szerv károsodását jelezni. A miRNS-ek olyan RNS molekulák, melyek fehérjét nem kódolnak, de kapcsolódni tudnak az mRNS-ek 3’ nem transzlálódó régiójához, és gátolják annak átírását, valamint indukálják degradációját. A miRNS-ek funkcionális szempontból meghatározott hányada extracelluláris vezikulákban találhatóak. Az új biomarker-jelöltek validálását in vitro patkány sejt-modellen és in vivo kisállat modellen végzik.
3.4. Immunszuppresszió hatékonyságának megállapítása in vitro modellben
A kutatók ex vivo immunstimuláción alapuló modellt dolgoztak ki perifériás vér mononukleáris sejteken, amellyel immunszuppresszív hatóanyagok jellemezhetők a pro-inflammatorikus citokinek expressziójára gyakorolt gátló hatásuk alapján. A modellt a szervtranszplantáció utáni immunszuppressziós terápia hatékonyságának vizsgálatára, illetve az esetlegesen kialakuló akut rejekciós események immunológiai hátterének vizsgálatára kívánják alkalmazni.
Műszerek, berendezések:
- Sejt-tenyésztő laboratórium CO2-inkubátorral, steril fülkével, mikroszkóppal
- HPLC UV-VIS, radiodetektor
- Fluoriméter
- NanoDrop 1000 spektrofotométer
- Real-time PCR és end-point PCR készülékek (BioRad)
- Fluidigm BiomarkTM HD nagy áteresztőképességű PCR rendszer
- Bio-Rad Droplet Digital PCR rendszer
- QuantStudio 5 real-time PCR rendszer
- Agilent 4200 TapeStation nukleinsav analizátor
- Western blot analízishez szükséges készülékek
- Ultracentrifuga
Együttműködések:
- Faculty of Medicine, University of Ljubljana, Ljubljana, Szlovénia – A koleszterin homeosztázis és a gyógyszer-metabolizmus kapcsolata
- Palacky University, Olomouc, Cseh Köztársaság – Szteroid típusú vegyületek (dexametazon, dehidroepiandroszteron) hatása a gyógyszer-metabolizáló citokróm P450 enzimekre
- INSERM (Institut National de la Santé et de la Recherche Médicale) U632, Montpellier, Franciaország – Nukleáris receptorok a citokróm P450 gének szabályzásában betöltött szerepének vizsgálata
- Cambridge-i Egyetem, Klinikai Idegtudományi Tanszék, Lakatos csoport – ALS/FTD organoid modellek fejlesztése
- Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika, Budapest – Transzplantált betegek gyógyszer-lebontó képességének vizsgálata; A ciklosporin metabolizmusából fakadó toxicitás megelőzése és kivédése
- Semmelweis Egyetem, Városmajori Szív- és Érsebészeti Klinika – Szív-transzplantált betegek gyógyszer-lebontó képességének vizsgálata; immunszuppresszív gyógyszerek metabolizmusából fakadó toxicitás megelőzése és kivédése
- Semmelweis Egyetem, Pszichiátriai és Pszichoterápiás Intézet Kórháza – Személyre szabott antipszichotikum terápia kialakításának lehetőségei
- Semmelweis Egyetem II. sz. Gyermekklinika, Budapest – CYP kópiaszám változások daganatos szövetekben
- Heim Pál Gyermekkórház, Madarász utcai Kórháza, Budapest – Személyre szabott antiepileptikum terápia kialakítása
- Egyesített Szent István és Szent László Kórház Rendelőintézet, Budapest – Személyre szabott terápia kialakítása csontvelő transzplantált betegeknél
- Országos Korányi TBC és Pulmonológia Intézet – A gyógyszerrezisztencia mechanizmusainak vizsgálata, célzott terápiák tervezése
- Energiatudományi Kutatóközpont, Mikrorendszerek Laboratóriuma – Fiziológiás organoid tenyésztési technológia kidolgozása
Oktatási tevékenység:
- Semmelweis Egyetem, Budapest
- Eötvös Loránd Tudományegyetem, Budapest
- Budapesti Műszaki és Gazdaságtudományi Egyetem, Budapest
Válogatott publikációk:
Szebényi K, Wenger LMD, Sun Y, Dunn AWE, Limegrover CA, Gibbons GM, Conci E, Paulsen O, Mierau SB, Balmus G and Lakatos A: Human ALS/FTD Brain Organoid Slice Cultures Display Distinct Early Astrocyte and Targetable Neuronal Pathology. Nature Neuroscience 24: 1542–1554, 2021
Déri M, Szakál-Tóth Zs, Fekete F, Mangó K, Incze E, Minus A, Merkely B, Sax B, Monostory K: CYP3A-status is associated with blood concentration and dose-requirement of tacrolimus in heart transplant recipients Scientific Reports 11: 21389, 2021
Fekete F, Mangó K, Déri M, Incze E, Minus A, Monostory K: Impact of genetic and non-genetic factors on hepatic CYP2C9 expression and activity in Hungarian subjects. Scientific Reports 11: 17081, 2021
Csikány N, Kiss Á, Déri M, Fekete F, Minus A, Tóth K, Temesvári M, Sárváry E, Bihari L, Gerlei Zs, Kóbori L, Monostory K: Clinical significance of personalized tacrolimus dosing by adjusting to donor CYP3A-status in liver transplant recipients. British Journal of Clinical Pharmacology 87: 1790–1800, 2021
Menus Á, Kiss Á, Tóth K, Sirok D, Déri M, Fekete F, Csukly G, és Monostory K: Association of clozapine-related metabolic disturbances with CYP3A4 expression in patients with schizophrenia. Scientific Reports 10: 212383, 2020
Déri M. T, Kiss Á. F, Tóth K, Paulik J, Sárváry E, Kóbori L, Monostory K: End-stage renal disease reduces the expression of drug-metabolizing cytochrome P450s. Pharmacological Reports 72: 1695–1705, 2020
Kiss Á, Menus Á, Tóth K, Déri M, Sirok D, Gabri E, Belic A, Csukly G, Bitter I, Monostory K: Phenoconversion of CYP2D6 by inhibitors modifies aripiprazole exposure. European Archives of Psychiatry and Clinical Neuroscience 270: 71–82, 2019
Monostory K, Nagy A, Tóth K, Bűdi T, Kiss Á, Déri M, Csukly G: Relevance of CYP2C9 function in valproate therapy. Current Neuropharmacology 17: 99–106, 2019
Kiss Á. F, Vaskó D, Déri M. T, Tóth K, Monostory K: Combination of CYP2C19 genotype with non-genetic factors evoking phenoconversion improves phenotype prediction. Pharmacological Reports 70: 525–532, 2018
Kiss Á, Tóth K, Juhász C, Temesvári M, Paulik J, Hirka G, Monostory K: Is CYP2D6 phenotype predictable from CYP2D6 genotype? Microchemical Journal 136: 209-214, 2018
Tóth K, Csukly G, Sirok D, Belic A, Kiss Á, Háfra E, Déri M, Menus Á, Bitter I, Monostory K: Potential role of patients’ CYP3A-status in clozapine pharmacokinetics. International Journal of Neuropsychopharmacology 20: 529-537, 2017
Tóth K, Csukly G, Sirok D, Belic A, Háfra E, Kiss Á, Déri M, Menus Á, Bitter I, Monostory K: Optimization of clonazepam therapy adjusted to patient’s CYP3A-status and NAT2 genotype. International Journal of Neuropsychopharmacology 19: 1-9, 2016
Bűdi T, Tóth K, Nagy A, Szever Z, Kiss Á, Temesvári M, Háfra E, Garami M, Tapodi A, Monostory K: Clinical significance of CYP2C9-status guided valproic acid therapy in children. Epilepsia 56: 849-855, 2015
Monostory K, Tóth K, Kiss Á, Háfra E, Csikány N, Paulik J, Sárváry E, Kóbori L: Personalizing calcineurin inhibitor therapy by adjusting to donor CYP3A-status in liver transplant patients British Journal of Clinical Pharmacology 80: 1429-1437, 2015
Tóth K, Bűdi T, Kiss Á, Temesvári M, Háfra E, Nagy A, Szever Z, Monostory K: Phenoconversion of CYP2C9 in epilepsy limits the predictive value of CYP2C9 genotype in optimizing valproate therapy. Personalized Medicine 12: 199-207, 2015
Szebényi K, Péntek A, Erdei Z, Várady G, Orbán TI, Sarkadi B, Apáti Á: Efficient generation of human embryonic stem cell-derived cardiac progenitors based on tissue-specific enhanced green fluorescence protein expression. Tissue Engineering, Part C: Methods 21: 35-45, 2015
Szebényi K, Füredi A, Kolacsek O, Csohány R, Prókai Á, Kis-Petik K, Szabó A, Bősze Z, Bender B, Tóvári J, Enyedi Á, Orbán TI, Apáti Á, Sarkadi B: Visualization of Calcium Dynamics in Kidney Proximal Tubules. Journal of the American Society of Nephrology 26: 2731-2740, 2015
Szebényi K, Füredi A, Kolacsek O, Pergel E, Bősze Z, Bender B, Vajdovich P, Tóvári J, Homolya L, Szakács G, Héja L, Enyedi Á, Sarkadi B, Apáti Á, Orbán TI: Generation of a Homozygous Transgenic Rat Strain Stably Expressing a Calcium Sensor Protein for Direct Examination of Calcium Signaling. Scientific Reports 5: 12645, 2015
Belic A, Tóth K, Vrzal R, Temesvári M, Porrogi P, Orbán E, Rozman D, Dvorak Z, Monostory K: Dehydroepiandrosterone post-transcriptionally modifies CYP1A2 induction involving androgen receptor. Chemico-Biological Interactions 203: 597-603, 2013
Temesvári M, Kóbori L, Paulik J, Sárváry E, Belic A, Monostory K: Estimation of drug-metabolizing capacity by cytochrome P450 genotyping and expression. Journal of Pharmacology and Experimental Therapeutics 341: 294-305, 2012
Temesvári M, Paulik J, Kóbori L, Monostory K: High-resolution melting curve analysis to establish CYP2C19*2 single nucleotide polymorphism: comparison with hydrolysis SNP analysis. Molecular and Cellular Probes 25: 130-133, 2011
Monostory K, Dvorak Z: Steroid regulation of drug-metabolizing cytochromes P450. Current Drug Metabolism 12: 154-172, 2011
Rezen T, Rozman D, Pascussi J-M, Monostory K: Interplay between cholesterol and drug metabolism. Biochim Biophys Acta – Proteins and Proteomics 1814: 146-160, 2011
Rozman D, Monostory K: Perspectives of the non-statin hypolipidemic agents. Pharmacology and Therapeutics 127: 19-40, 2010
Belic A, Temesvári M, Kőhalmy K, Vrzal R, Dvorak Z, Rozman D, Monostory K: Investigation of the CYP2C9 induction profile in human hepatocytes by combining experimental and modelling approaches. Current Drug Metabolism 10: 457-461, 2009
Monostory K, Pascussi J-M, Kóbori L, Dvorak Z: Hormonal regulation of CYP1A expression. Drug Metabolism Reviews 41: 547-572, 2009
Monostory K, Pascussi J-M, Szabó P, Temesvári M, Kőhalmy K, Acimovic J, Kocjan D, Kuzman D, Wilzewski B, Bernhardt R, Kóbori L, Rozman D: Drug-interaction potential of 2-((3,4-(dichlorophenethyl(propyl)amino)-1-(pyridin-3-yl)ethanol (LK-935), the novel non-statin type cholesterol lowering agent. Drug Metabolism and Disposition 37: 375-385, 2009
Kóbori L, Kőhalmy K, Porrogi P, Sárváry E, Gerlei Zs, Fazakas J, Nagy P, Járay J, Monostory K: Drug-induced liver graft toxicity caused by cytochrome P450 poor metabolism. British Journal of Clinical Pharmacology 65: 428-436, 2008
Kőhalmy K, Tamási V, Kóbori L, Sárváry E, Pascussi J-M, Porrogi P, Rozman D, Prough RA, Meyer UA, Monostory K: Dehydroepiandrosterone induces human CYP2B6 through the constitutive androstane receptor. Drug Metabolism and Disposition 35: 1495-1501, 2007
Monostory K, Kőhalmy K, Prough, RA, Kóbori L, Vereczkey L: The effect of synthetic glucocorticoid, dexamethasone on CYP1A1 inducibility in adult rat and human hepatocytes. FEBS Letters 579: 229-235, 2005
Monostory K, Hazai E, Vereczkey L: Inhibition of cytochrome P450 enzymes participating in p-nitrophenol hydroxylation by drugs known as CYP2E1 inhibitors. Chemico-Biological Interactions 147: 331-340, 2004
Szűcs G, Tamási V, Laczay P, Monostory K: Biochemical background of toxic interaction between tiamulin and monensin. Chemico-Biological Interactions 147: 151-161, 2004
Tamási V, Hazai E, Porsmyr-Palmertz M, Ingelman-Sundberg M, Vereczkey L, Monostory K: GYKI-47261, a new AMPA antagonist is a CYP2E1 inducer. Drug Metabolism and Disposition 31:1310-1314, 2003
Tamási V, Vereczkey L, Falus A, Monostory K: Some aspects of interindividual variations in the metabolism of xenobiotics. Inflammation Research 52:322-333, 2003
Hazai E, Vereczkey L, Monostory K: Reduction of toxic metabolite formation of acetaminophen. Biochemical Biophysical Research Communications 291: 1089-1094, 2002
Tamási V, Kiss Á, Dobozy O, Falus A, Vereczkey L, Monostory K: The effect of dexamethasone on P450 activities in regenerating liver. Biochemical Biophysical Research Communications 286: 239-242, 2001
Monostory K, Vereczkey L, Lévai F, Szatmári I: Iprifalvone as an inhibitor of human cytochrome P450 enzymes. British Journal of Pharmacology 123: 605-610, 1998
Monostory K, Jemnitz K, Vereczkey L, Czira G: Species differences in metabolism of panomifene, an analogue to tamoxifen. Drug Metabolism and Disposition 25: 1370-1378, 1997
Monostory K, Vereczkey L: The effect of phenobarbital and dexamethasone coadministration on the activity of rat liver P450 system. Biochemical Biophysical Research Commununications 203: 351-358, 1994
Vezető
Monostory Katalin









